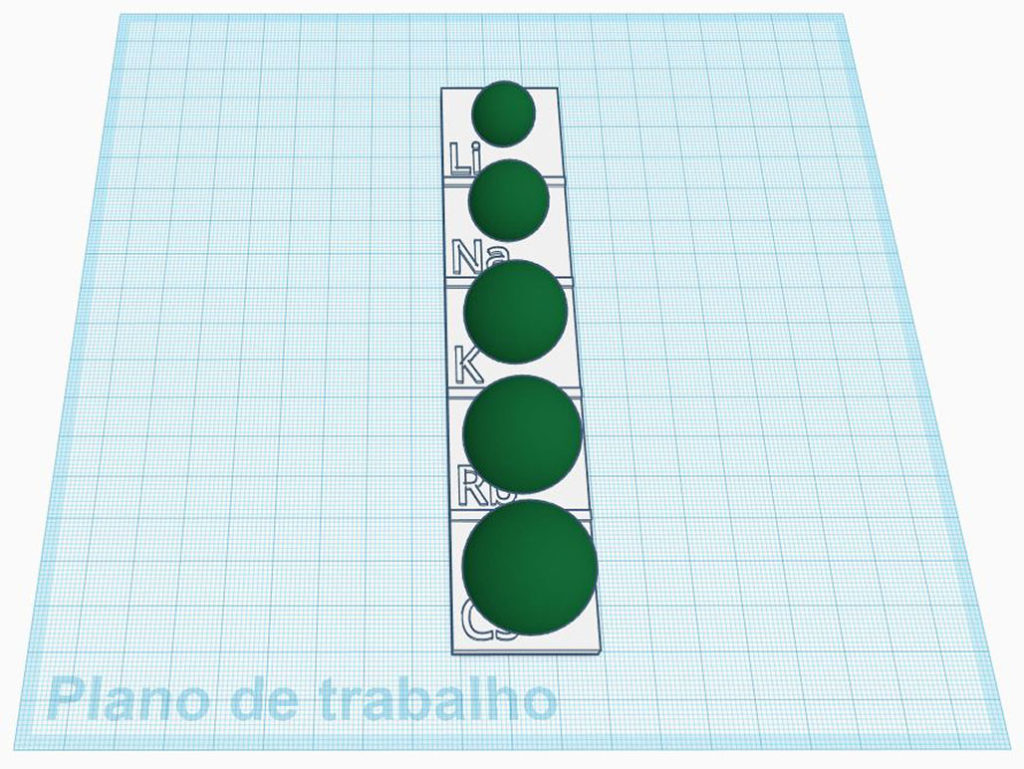
O QUE É
Um modelo dos átomos dos metais alcalinos em escala. A base contém os símbolos os elementos como na Tabela Períodica e as esferas representam os átomos.
PORQUE É INTERESSANTE?
O modelo mostra a variação dos tamanhos dos átomos ao longo de uma família dos elementos químicos. O raio atômico é a distância entre o núcleo do átomo e a sua camada mais externa. O raio atômico aumenta à medida que descemos em uma coluna da Tabela Periódica. Usando o modelo de Bohr, podemos explicar essa variação no raio atômico pelo aumento no número de camadas na distribuição eletrônica. O lítio apresenta duas camadas, que são preenchidas ao longo do segundo período. Quando se chega no sódio, se inicia uma nova camada, ou seja o último elétron fica mais distante do núcleo do átomo. O mesmo se repete para os outros metais alcalinos, que vão ficando cada vez maiores.
COMO USAR
O modelo é usado como um apoio visual e manipulativo para os estudantes. Pode ser usado como parte de uma avaliação, em que os alunos recebem o modelo e devem explicar a tendência observada.
FAÇA O SEU
Baixe o arquivo do Thingiverse: https://www.thingiverse.com/thing:3999106
O modelo foi criado usando o programa de modelagem online Tinkercad (https://www.tinkercad.com). Os átomos foram impressos em uma cor diferente da base, mas isso é opcional. Cada átomo é uma esfera com um diâmetro em milímetros que segue os raios atômicos dos elementos em picômetros (um picômetro corresponde a 10‾¹² metros). Seguimos os valores da tabela abaixo.
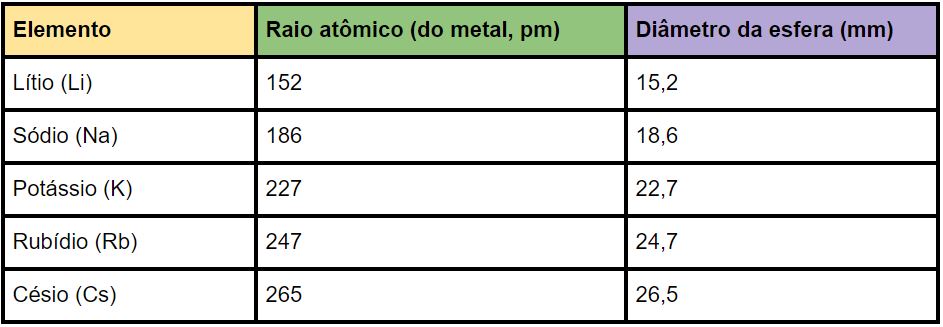

O último elemento dos metais alcalinos, o frâncio, não possui dados de raio atômico por ser radioativo e ter uma meia vida muito baixa.
Os dados foram obtidos de https://en.wikipedia.org/wiki/Atomic_radii_of_the_elements_(data_page).
Os átomos foram colados na base com super cola para evitar que as esferas caiam e se percam.
+CIÊNCIA
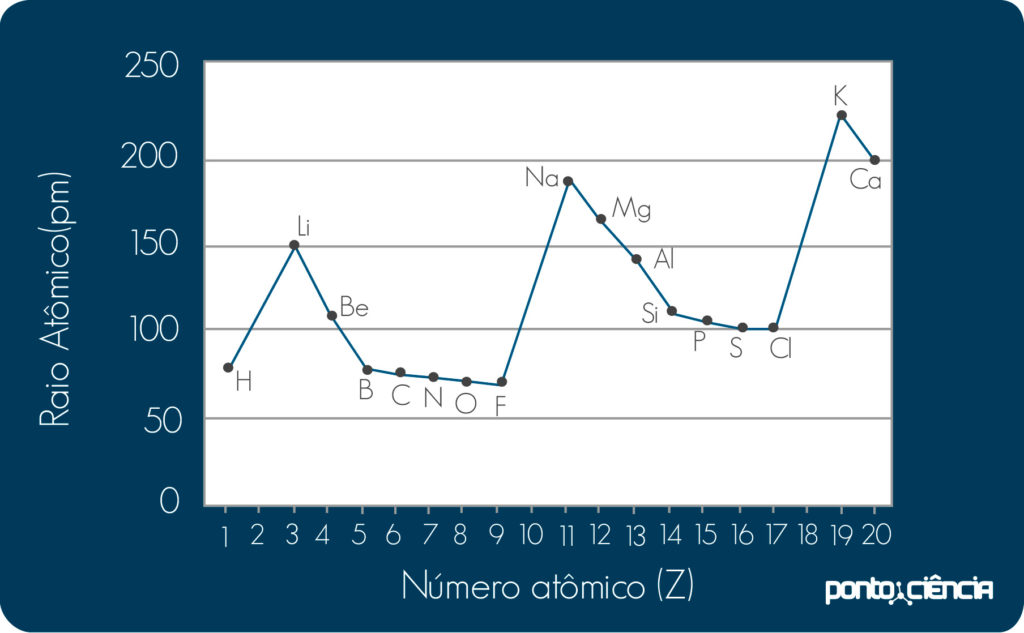
O raio atômico é uma propriedade periódica, ou seja, a cada novo período da tabela periódica, vamos a tendência se repetindo. A imagem abaixo mostra a variação dos raios atômicos para os primeiros 20 elementos (com a exceção dos gases nobres). Podemos notar que os raios dos elementos alcalinos, lítio (Li), sódio (Na) e potássio (K) aumentam. Isso acontece porque ao descermos na mesma coluna, os átomos apresentam mais camadas e os últimos elétrons ficam mais distantes do núcleo. Também podemos notar que ao andarmos ao longo de um período da tabela (por exemplo, do lítio até o flúor (F)), os raios diminuem. A explicação, neste caso, passa pelo aumento da carga do núcleo. Como átomos mais á direita no período possuem mais prótons no núcleo (maior número atômico), eles atraem os elétrons mais fortemente, causando uma contração do átomo.