Quando ácido clorídrico (o mesmo presente no nosso estômago) é adicionado gota a gota a uma mesma quantidade de água e de água em que um tablete anti-ácido efervescente foi adicionado, percebemos que é necessário uma quantidade muito maior de ácido para se mudar a cor do indicador universal. Veja como usar este experimento na sua aula para explicar o funcionamento de uma solução tampão.
Prepare o experimento
Coloque 20 mL de água destilada em cada uma das pré-formas. Adicione 10 gotas de indicador universal e uma gota de hidróxido de sódio 0,1 mol/L nos dois tubos.

Execute o experimento
Quando ácido clorídrico (o mesmo presente no nosso estômago) é adicionado gota a gota a uma mesma quantidade de água e de água em que um tablete anti-ácido efervescente foi adicionado, percebemos que é necessário uma quantidade muito maior de ácido para se mudar a cor do indicador universal. Veja no vídeo acima como usar este experimento na sua aula para explicar o funcionamento de uma solução tampão.
A ideia é usar a água pura como um controle, que será comparado com o sistema contendo o comprimido efervescente. Chame a atenção dos alunos para o que acontece quando se coloca uma única gota de solução de ácido clorídrico no tubo contendo apenas água. Mesmo diluindo o ácido na água, a solução fica ácida o suficiente para alterar a coloração do indicador universal, que inicialmente está roxo, indicando uma solução alcalina (pH de 11 a 14), para uma coloração avermelhada, que indica uma solução muito ácida (pH de 0 a 2).
Na sequência, coloque um pedaço pequeno do comprimido antiácido efervescente e espere até que a reação termine, agitando o tubo para liberar o gás. Chame a atenção para a coloração em que o sistema de encontra e adicione o ácido clorídrico gota a gota, agitando o tubo a cada adição. Peça para os alunos contarem o número de gotas necessárias para que a cor da solução fique igual à cor do tubo que continha apenas água.
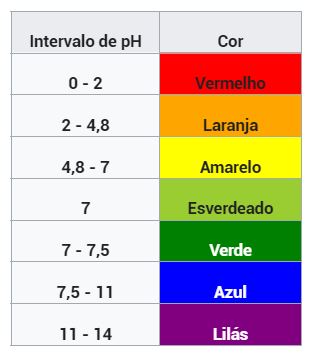
O indicador universal é uma mistura de indicadores ácido-base, o que permite que vejamos diversas mudanças de cor à medida em que o pH da solução varia.
Uma combinação de indicadores muito usada para fazer o indicador universal contém azul de timol, vermelho de metila, azul de bromotimol e fenolftaleína.
O que acontece
O comprimido anti-ácido efervescente contém bicarbonato de sódio e ácido cítrico (C6H8O7). Quando o comprimido é colocado em água, estes dois componenetes se dissolvem e reagem, produzindo citrato de sódio e liberando gás carbônico. O bicarbonato de sódio é colocado em excesso, de modo a neutralizar completamente os três hidrogênios ionizáveis do ácido cítrico.
O citrato de sódio se comporta como um anti-ácido porque o citrato é o ânion de um ácido fraco. Sendo assim, ele reage com o excesso de ácido no estômago, consumindo o ácido e formando o ácido cítrico.
Uma solução tampão é uma solução cujo pH muda muito pouco com a adição de ácidos ou bases. Este tipo de solução é muito empregada para se manter o pH fixo ao longo de experimentos, especialmente na área biológica ou bioquímica. O nosso corpo mantém o pH constante nos fluidos biológicos como o sangue usando sistema tampão.
Mas como as soluções tampão funcionam? Soluções tampão contém uma combinação de um ácido fraco ou base fraca e o sal desse ácido ou base. Um bom exemplo seria o tampão formado por uma mistura contendo ácido acético e acetato de sódio, em quantidades semelhantes. Quando se adiciona mais ácido a esta mistura, o íon acetato se liga a esse excesso de íons H+, formando mais ácido acético, mantendo a concentração de íons hidrogênio (e o pH) constante. Da mesma forma, adicionar uma base altera muito pouco o pH, pois ela é consumida pela reação com o ácido acético presente. Veja as equações abaixo.
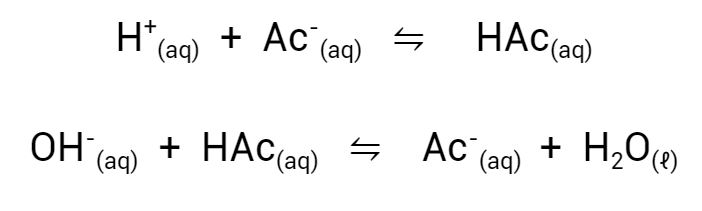
O sistema tampão do comprimido efervescente é muito semelhante, mas usa o ácido cítrico no lugar de ácido acético. O ácido cítrico possui 3 hidrogênios ionizáveis. O tampão é formado a partir da neutralização do ácido cítrico com o bicarbonato, formando citrato de sódio.
Finalmentes
Equilíbrio Químico é um tópico importante e que pode ser muito complicado de se entender. Experimentos podem trazer o foco para os fenômenos relacionados ao equilíbrio químico, sua explicação e sua aplicação, ao invés de colocar nossos esforços unicamente na resolução de exercícios numéricos, sem que o aluno consiga relacionar o que está no exercício com a realidade.
Gostou deste experimento? Pensa em usá-lo nas suas aulas? Deixe um comentário abaixo e compartilhe nosso site nas suas redes!

