Objetos em 3 dimensões tem propriedades muito interessantes. A simetria é uma delas. Quando você executa uma certa operação num objeto e ele parece não ter mudado, dizemos que o objeto é simétrico ou que possui uma certa simetria. Por exemplo, se você rodar um cubo em um ângulo de 90 graus, ele irá aparecer idêntico à situação anterior. Da mesma forma, quando você o divide por um determinado plano, ele aparece como se houvesse um espelho entre as duas metades. Entender a geometria de moléculas é muito importante na Química, mas ao mesmo tempo não é uma tarefa fácil. Visualizar formas em três dimensões como algo abstrato, apenas na cabeça não é algo que estamos acostumados. Neste artigo vamos ver como a impressão 3D de um modelo pode nos ajudar a entender conceitos que dependem da geometria espacial da molécula, como a isomeria ótica.

ISOMERIA PLANA OU ESTRUTURAL
Isômeros são moléculas que possuem os mesmos átomos, porém são diferentes em algum aspecto. Existem vários tipos de isômeros, dependendo de como aparece a diferença entre as moléculas. Os tipos mais simples aparecem quando temos compostos do mesmo tipo, mas com alguma mudança na posição de um pedaço da molécula em relação à outra. Por exemplo, dois hidrocarbonetos podem diferir apenas na posição de uma ramificação na cadeia.
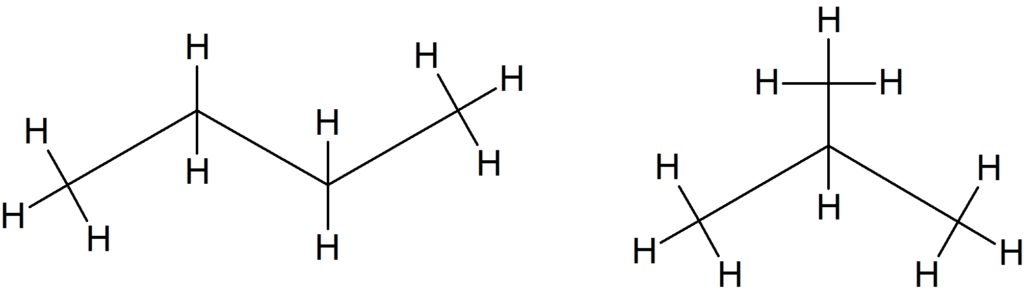
Se você contar o número de carbonos e hidrogênios, vai ver que os dois compostos desenhados possuem a mesma fórmula, C4H10. Mas olhando para as fórmulas estruturais fica fácil perceber que se tratam de compostos diferentes. Este tipo de isomeria é chamado de isomeria plana porque podemos perceber a diferença olhando para uma estrutura desenhada numa folha de papel, como as imagens acima. Ou seja, o fato da molécula na realidade ser tridimensional não muda nada em termos do arranjo dos átomos.
Não vou falar sobre todos os tipos de isomeria plana, pois não é o ponto deste artigo e você pode encontrar resumos bem completos em livros e sites. Vamos direto ao ponto deste artigo, os isômeros espaciais.
ISOMERIA ESPACIAL
Já a isomeria espacial é algo diferente. A diferença entre isômeros espaciais se dá no arranjo das partes da molécula no espaço tridimensional. Só desenhar a molécula no plano não resolve neste caso. Além de termos os mesmos átomos (mesma fórmula molecular), os átomos estão ligados entre si da mesma maneira. O que muda é a posição de parte da molécula no espaço.
Um tipo interessante de isomeria espacial é a isomeria ótica. Compostos que são isômeros óticos são chamados de enantiômeros e eles são relacionados entre si por uma reflexão em um espelho.
Um átomo de carbono que faz quatro ligações simples pode dar origem a isômeros óticos. Isso ocorre quando temos quatro grupos diferentes ligados a esse carbono. Se pegarmos o metano, CH4, e substituirmos 3 hidrogênios por outros átomos como flúor, cloro e bromo, por exemplo, teremos 4 grupos diferentes ao redor do carbono e duas possibilidades de arranjar os átomos ao redor do átomo central.
Os dois isômeros óticos possuem as mesmas propriedades como temperatura de fusão, solubilidade, etc. Eles podem ser diferenciados pela maneira com interagem com a luz polarizada. O plano da luz polarizada gira em direções opostas dependendo de qual isômero interage com a luz e é daí que vem o nome isomeria ótica.
Você poderia criar os dois enantiômeros em um programa de modelagem molecular e girar a molécula para de vários ângulos. Mas ter um modelo na mão para entender o conceito é algo que muitos alunos podem considerar vantajoso para entender as diferenças entre eles. Você também pode argumentar que seria muito fácil montar esses modelos usando um modelo molecular convencional. Sem dúvida essa é uma maneira muito simples de ter modelos para demonstrar isso e muitas outras características das moléculas. Mas caso você queira ter um modelo separado e pronto para usar nessa aula, o modelo que nós desenvolvemos é uma opção interessante. Outra vantagem deste modelo é que ele não possui peças que possam se soltar e se perder, é uma peça única e resistente.

FAÇA O SEU
Baixe o modelo do Thingiverse: https://www.thingiverse.com/thing:4264511
O modelo de tetraedro foi criado inicialmente no programa gratuito de modelagem Avogadro. Este modelo foi salvo no formato PDB e convertido para o formato da impressão 3D (STL) no Chimera. Modificamos esse STL no Tinkercad colocando sólidos geométricos em três das pontas do tetraedro.
Temos um arquivo .STL para cada isômero ótico. Inclui ainda um modelo de um átomo de carbono tetraédrico sem substituintes e de um tetraedro (o sólido geométrico). Todas essas peças possuem um furo inferior e se encaixam em uma base, onde podem ser rodados.
Criamos também um modelo em que bolas podem encaixadas nas pontas do tetraedro e que podem ser impressas com filamentos de cores diferentes.
As peças foram impressas em PLA, com 0,2 mm de altura da camada e 10% de recheio, usando suportes.


Desenvolvemos também um segundo modelo que tem um tetraedro central e 4 bolas de cores diferentes. Neste caso as bolas podem ser retiradas e colocadas em posições diferentes. Estes modelos estão disponíveis para empréstimo para professores de Química no laboratório do COLTEC.
FINALMENTES
Este foi só um artigo rápido para mostrar a ideia do modelo. Você usaria um modelo como esse em suas aulas? Como ele poderia ser melhorado? Deixe um comentário abaixo e compartilhe a postagem se você gostou.


1 comentário
[…] xmaker […]