Neste artigo trazemos mais um experimento que pode ser usado para investigar as interações moleculares. Neste caso, vamos focar em dois polímeros que são usados para proteger produtos frágeis durante o seu transporte. Assista o vídeo abaixo para ver o experimento.
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
Poliestireno expandido - o "isopor"
É interessante perceber o quanto um mesmo material pode assumir formas diferentes. O poliestireno é um polimero que é muito usado para fazer, entre outras coisas, talheres e copos descartáveis. Quando usado nesses produtos, é um plástico transparente e quebradiço. Mas encontramos esse mesmo polímero na forma de “isopor”, com propriedades bem diferentes. O isopor é muito pouco denso, opaco e um tanto flexível.

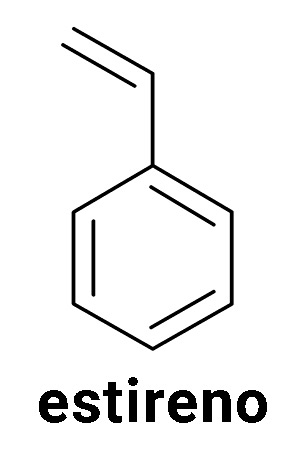
“Isopor” é um nome comercial, uma marca atribuída ao poliestireno expandido (EPS). A marca ficou tão conhecida que acabamos usando o seu nome no lugar do nome do material. Mas o que é o poliestireno expandido? O estireno (veja a imagem abaixo, à esquerda) é um líquido incolor que apresenta um anel aromático e uma ligação dupla. A ligação dupla permite que as moléculas do estireno possam reagir entre si, formando grandes cadeias. Dizemos que o estireno é um monômero, uma molécula que pode dar origem a um polímero, neste caso, o poliestireno.

É muito comum encontrarmos produtos embalados com o poliestireno expandido. Ele é usado especialmente com produtos frágeis (eletrônicos, por exemplo). Quando abrimos uma caixa contendo uma televisão ou monitor de computador, podemos ver que a empresa fez um molde em que o produto se encaixa exatamente no isopor e este por sua vez ocupa perfeitamente a caixa. Mas, e se você quiser enviar um objeto frágil como um vaso de vidro em uma caixa pelo correio, ou quiser transportar esse objeto em um carro sem correr o risco dele se quebrar? Você não tem como fazer um molde para o seu objeto, mas pode encher uma caixa com pedacinhos de isopor ao redor do seu vaso, e eles irão amortecer qualquer batida.
É fácil perceber que apesar de serem muito práticos, estes pedaços de isopor terão uma vida útil muito curta. Embora possamos reutilizar as peças de isopor inúmeras vezes, ao terminar o transporte do objeto, eles provavelmente serão descartados, já que ocupam um grande espaço e não têm outra utilidade.
Amido termoplástico - o "isoporito"
O que nós estamos chamando aqui de “isoporitos” na verdade são flocos de proteção para o preenchimento de embalagens (caixas) que são fabricados a partir de milho e não de poliestireno expandido. Você pode encontrar esse tipo de material sendo vendido como “EcoFill” ou “extrusado de milho”. Dê uma busca por “flocos de preenchimento de caixas biodegradável” ou algo semelhante e você irá encontrar diversas opções. Infelizmente, em geral as quantidades vendidas são bem grandes, muito mais do que você vai precisar mesmo que faça experimentos com eles por algumas décadas… Mas caso você encontre esse material ou conheça alguém que tenha acesso, já sabe que vale a pena guardar para essa atividade.

Podemos fazer um experimento inicial que vai nos informar melhor sobre o material que é usado na produção do floco biodegradável. Para isso, vamos utilizar uma solução de tintura de iodo, disponível em farmácias. Esta solução contém 2% em massa de iodo (I2) dissolvido em álcool etílico e água, com um pouco de iodeto de potássio para aumentar a solubilidade do iodo.
Pingue uma gota da tintura de iodo no floco. Para comparação, pingamos a tintura de iodo no isopor.


Quando o iodo entra em contato com o amido, ele forma um complexo intensamente azul arroxeado. A cor é tão intensa que podemos achar que se formou um composto de cor preta. Esse teste funciona para outros materiais que contém amido, como batata, arroz, pão, farinha de trigo, etc.
O amido é um polímero da glicose. Como podemos ver na imagem abaixo, a sua estrutura contém grupos hidroxila (OH), que interagem bem com moléculas de água, mas não com solventes apolares.
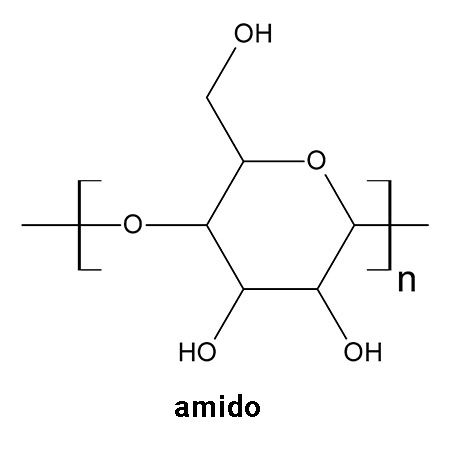
Interações com a água
Podemos comparar o que acontece com os dois materiais ao serem colocados em água. Você pode pedir para os alunos fazerem uma previsão sobre o que vai acontecer, baseados na estrutura molecular dos dois polímeros.

Interações com solventes orgânicos
Para este experimento, usamos o limoneno, um composto encontrado no óleo essencial da laranja. O limoneno é um hidrocarboneto, encontrado na casca da laranja. Embora devamos tomar cuidados no uso do limoneno, que é inflamável e pode irritar a pele, ele pode ser uma boa alternativa a outros solventes orgânicos, especialmente por ser um composto renovável, e não de origem fóssil. Outros solventes também podem ser usados, como acetona ou acetato de etila, mas eles devem estar puros, sem a adição de água ou etanol. As soluções usadas para remover esmaltes de unhas não funcionam com o isopor por que a presença de água e álcool aumenta muito a sua polaridade.
Finalmentes
Se você gostou destes experimentos e da explicação, não esqueça de compartilhar a postagem com colegas e amigos. Ficou com dúvida ou teve uma ideia brilhante? Deixe seu comentário abaixo.


1 comentário
[…] falamos sobre o isopor (poliestireno expandido) em um outro artigo no XCiência: http://www.xciencia.org/2023/05/18/o-caso-do-isoporito-interacoes-moleculares-3/. Nesse artigo discutimos como um solvente apolar, como o limoneno, consegue quebrar as interações […]