O teste de chama é um experimento clássico que permite investigar e discutir a estrutura atômica, em especial o modelo de Bohr. Neste artigo mostramos como montamos um kit para usar nas nossas aulas e discutimos um pouco da ciência por trás do experimento.
Preparando o experimento
Ao montar o nosso kit para o teste de chama, selecionamos alguns materiais que são relativamente fáceis de se achar.
Para a chama, usamos um maçarico portátil que é vendido para uso na culinária. Além do fato de ser portátil, o que permite que seja facilmente levado para a sala de aula, este maçarico tem a vantagem de ser recarregável. Ele usa o gás butano vendido para se recarregar isqueiros. Assim, é muito fácil recarregar o combustível após o uso.
Os sais que separamos para o teste são os cloretos de potássio, cálcio, sódio e cobre. Eles são relativamente fáceis de se achar e podem ser substituídos por outros sais com os mesmos cátions. Cloreto de cálcio anidro é usado em produtos anti-mofo, pois absorve umidade. Sais de cobre são usados para matar algas em produtos para piscinas. O cloreto de sódio é o sal de cozinha comum.
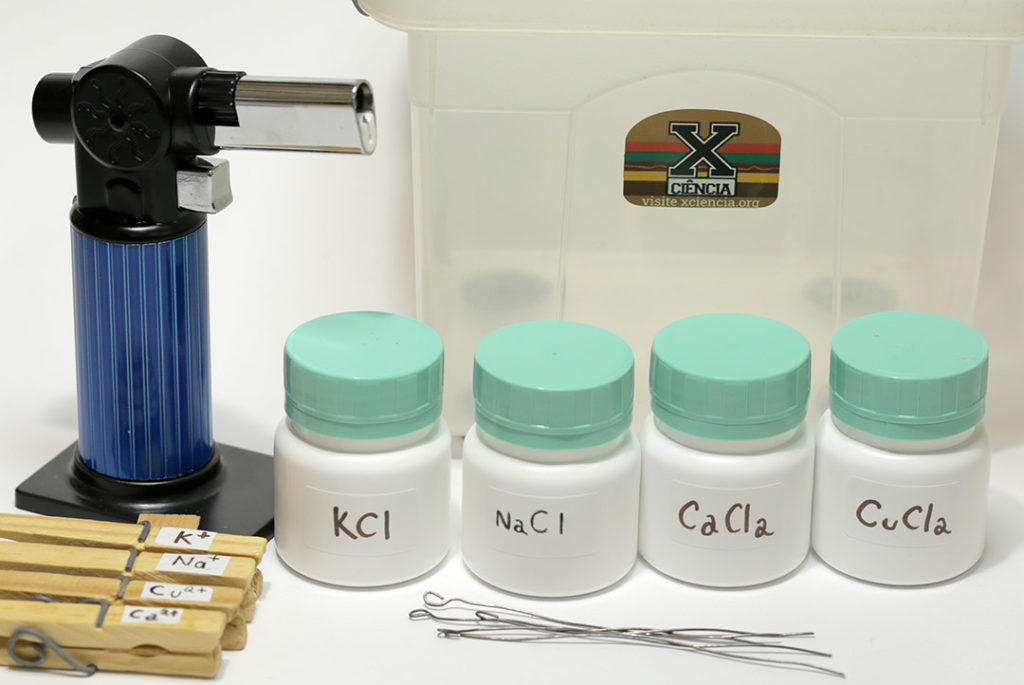
Incluímos também no kit pedaços de arame feitos a partir de uma resistência de chuveiro. Este arame é feito com uma liga de níquel-cromo que resiste bem à corrosão. Nós entortamos a ponta do arame com um alicate para fazer uma alça, o que aumenta a quantidade de cristais que conseguimos levar à chama. Por fim, usamos pregadores de roupa para segurar os arames enquanto eles são introduzidos na chama. É interessante rotular os pregadores para que cada arame seja usado sempre com o mesmo sal, evitando contaminação.
Realizando o experimento
Recomendamos que este experimento seja realizado como uma demonstração pelo professor, uma vez que ele envolve a manipulação de fogo e de materiais aquecidos.
Na hora do experimento, molhe a ponta do arama com uma gota de água destilada e encoste o arame molhado nos cristais do sal que se quer testar. Caso o sal tenha cristais muito grandes, pode ser interessante triturá-los com um almofariz para facilitar esta etapa.
Acendemos o maçarico e levamos o arame com o sal selecionado até a chama, como podemos ver nas imagens abaixo.



Chame a atenção dos alunos para as diferentes cores da luz emitida pelos sais inseridos na chama. Caso você tenha um espectroscópio como o descrito no artigo “Espectroscópio de papelão“, você pode usá-lo para mostrar aos alunos o espectro da luz emitida. Nas imagens abaixo, mostramos algumas fotos tiradas usando o espectroscópio usado juntamente com o teste de chama de diversos sais.





O que acontece
Uma maneira bem simplificada de se explicar o que acontece no teste de chama seria simplesmente dizer que os átomos presentes nos sais ganham energia na chama, indo para um estado de maior energia. Quando esses átomos voltam para um estado de menor energia, eles liberam a energia extra na forma de luz.
Podemos detalhar um pouco mais esta explicação introduzindo o modelo de Bohr para os átomos. Neste modelo, o átomo possui duas regiões: um minúsculo núcleo central, onde está concentrada quase toda a massa e a carga positiva do átomo; e a eletrosfera, a região ao redor do núcleo onde estão os elétrons. Os elétrons se movem ao redor do núcleo e podem ocupar órbitas a diferentes distâncias do núcleo. Quando um elétron está em uma órbita, ele possui energia constante. Ele pode ganhar energia e saltar para uma órbita mais distante do núcleo. O elétron não fica neste estado de maior energia, voltando para um nível de menor energia e emitindo radiação eletromagnética com um comprimento de onda que corresponde à diferença de energia entre a órbita inicial e a final.
O resultado disso é que quando olhamos para o espectro da luz emitida pelos átomos, vemos que apenas algumas cores são emitidas. Ou seja, no lugar de um arco-íris contínuo, com todas as cores, vemos apenas as cores que correspondem aos saltos eletrônicos. Nas imagens abaixos vemos o espectro de emissão de alguns dos átomos presentes no nosso kit.

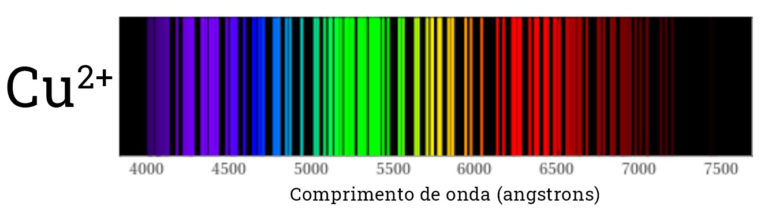
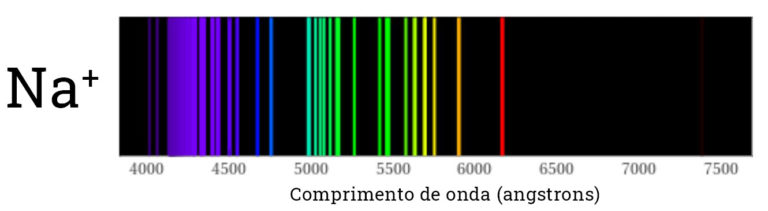
Dizemos que cada espectro é uma impressão digital do átomo presente na chama, pois não temos dois átomos com os mesmos níveis de energia e portanto cada um deles emite luz em diferentes comprimentos de onda. Quando olhamos para a cor da chama diretamente, sem o espectroscópio, geralmente vemos uma cor predominante. Alguns dos “pulos” dos elétrons são mais frequentes do que outros, o que torna sua emissão mais intensa.
Finalmentes
O teste de chama pode parece apenas um experimento que podemos usar para identificar elementos químicos, mas ele está ligado a fenômenos que vemos fora do laboratório como a cor que a chama do fogão fica quando derrubamos alguma comida, ou o espetáculo majestoso dos fogos de artifício.
Você tem interesse em fazer este experimento nas suas aulas? Comente abaixo. Compartilhe este experimento com seus colegas.


1 comentário
Muito bom, Alfredo.