Coloque dois líquidos lado a lado para competir e compare quem evapora primeiro. Será que seus alunos conseguem acertar suas previsões? este é um ótimo experimento para comparar a intensidade das interações moleculares de líquidos comuns.
Preparando a demonstração
Os líquidos que nós vamos usar nesta demonstração são:
- água;
- álcool etílico;
- acetona.
Vamos usar apenas algumas gotas de cada líquido, então colocamos cada um em um frasco conta-gotas.
Vamos precisar também de pedaços de algodão e de um quadro escuro. Nós usamos um pedaço de MDF, que nos cortamos usando o corte a laser. Fizemos também um suporte para que o quadro ficasse em pé sobre uma mesa. Caso a sua sala tenha um quadro negro do tipo para usar giz, você pode fazer a demonstração diretamente no quadro negro. Se for usar o quadro negro da sua sala, experimente em uma pequena área no canto, especialmente com a acetona, para verificar se os líquidos não irão afetar a tinta do quadro.
Apresentando a demonstração na sua aula
Ao apresentar a demonstração, sugerimos que você escolha dois dos líquidos para serem comparados lado a lado. Anotamos na faixa no alto do quadro os nomes das substâncias. Em seguida, molhe um pedaço de algodão com algumas gotas do primeiro líquido e repita o procedimento com outro pedaço de algodão molhando com o segundo líquido. Peça aos alunos para fazerem uma previsão sobre qual dos dois líquidos deve evaporar primeiro. Encoste os dois pedaços de algodão no quadro lado a lado e faça dois traços com o líquido, de mesmo tamanho, arrastando o algodão pelo quadro.
Acompanhe a evaporação dos líquidos e chame a atenção para qual deles foi o vencedor da corrida.
Repita o procedimento com outros pares de líquidos, sempre pedindo para que eles façam uma previsão antes do experimento e para que anotem o resultado de cada comparação. Peça a eles para usarem os seus conhecimentos sobre a estrutura dos compostos usados para chegarem ao tipo de interação molecular entre as moléculas presentes. A corrida pode ajudar os alunos a terem uma ideia sobre as intensidades relativas das interações moleculares em cada caso, pois elas estão ligadas à temperatura de ebulição de cada substância.
Veja o experimento no vídeo abaixo:
O que acontece
Na tabela abaixo apresentamos as estruturas e propriedades das substâncias usadas na demonstração:
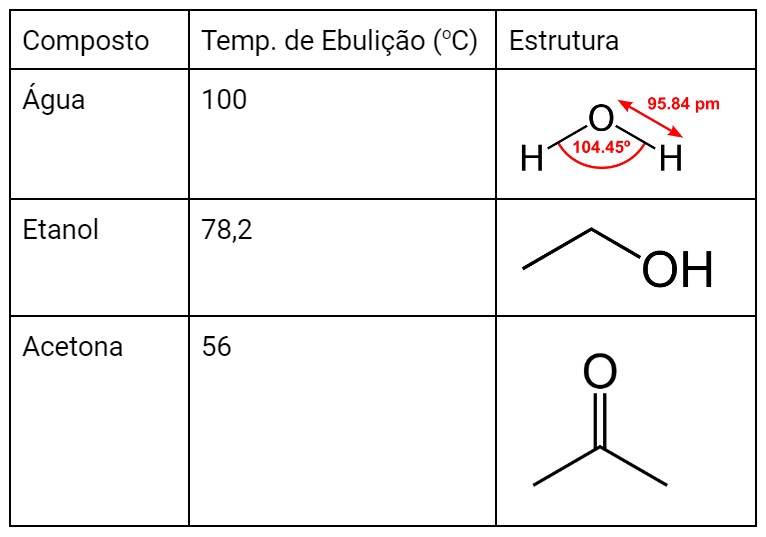
A água, e o etanol apresentam grupos hidroxila (-OH), o que faz com que eles tenham interações do tipo ligação de hidrogênio.
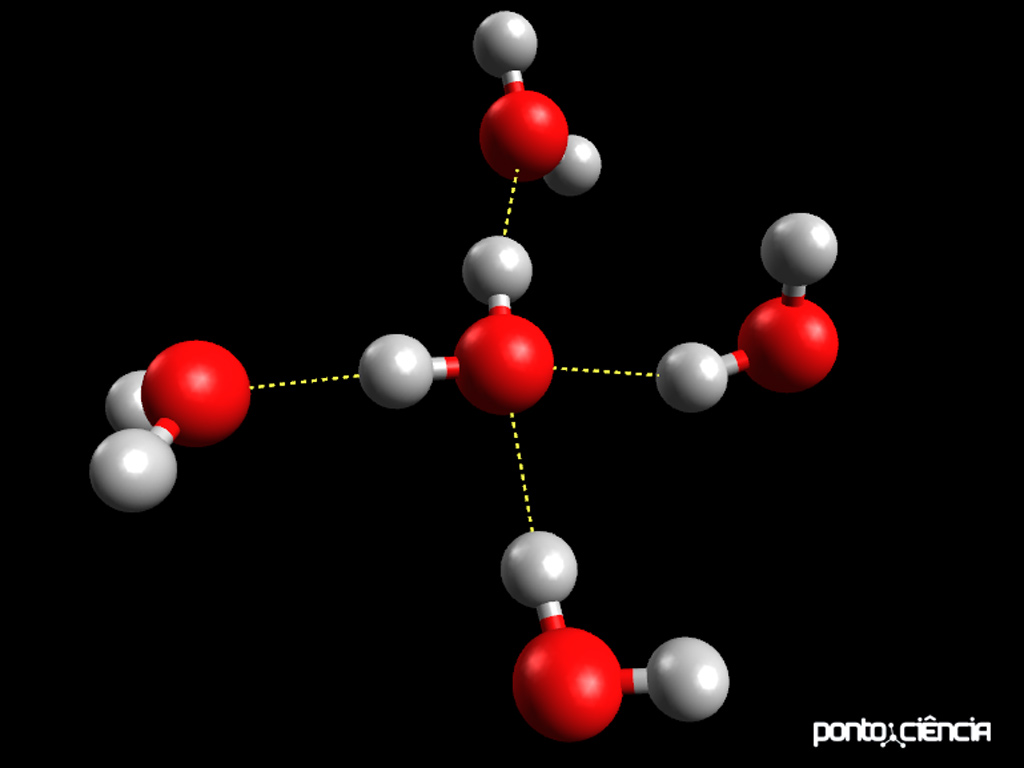
Ao compararmos a água com o etanol, poderíamos imaginar que o etanol, por ser uma molécula maior, teria uma temperatura de ebulição maior. Podemos ver na tabela acima que na verdade a temperatura de ebulição da água é que é maior. A água é uma molécula muito especial, apresentando uma temperatura de ebulição muito mais elevada que outras moléculas semelhantes (como a amônia, NH3 ou o sulfeto de hidrogênio, H2S). Podemos ver nas imagens abaixo, que uma molécula de água pode formar até 4 ligações de hidrogênio com outras moléculas de água vizinhas. Já o etanol pode, no máximo, fazer 3 ligações com moléculas vizinhas. Além disso, como a água é uma molécula muito mais polar que o etanol, essas ligações de hidrogênio são mais intensas que as do etanol.
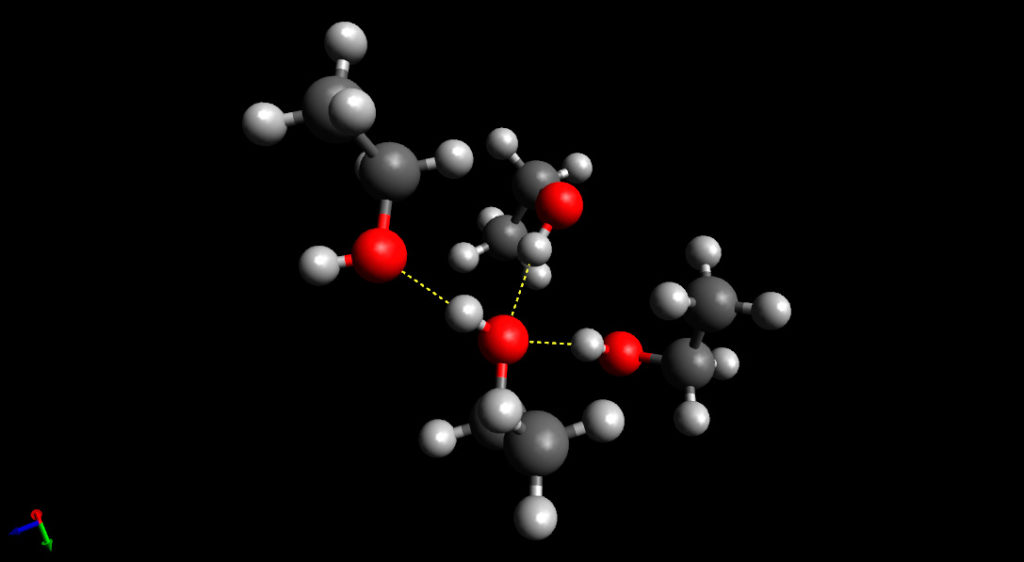
A acetona é uma molécula polar, e assim apresenta interações do tipo dipolo permanente – dipolo permanente. Mas não aparecem interações do tipo ligação de hidrogênio, cuja intensidade é relativamente maior do que a interação dipolo-dipolo.
Um cuidado importante ao falarmos sobre a intensidade das interações moleculares é sempre lembrar os estudantes de que essas comparações são relativas e não absolutas. Devemos comparar moléculas de tamanho similar para poder afirmar que um tipo de interação é mais forte que outro. Existem substâncias apolares sólidas, com interações mais fortes do que em outras substâncias polares ou mesmo com ligações de hidrogênio.
Finalmentes
Esta demonstração permite uma discussão bem rica sobre o tipo e a intensidade relativa das interações moleculares de líquidos conhecidos dos alunos. Além disso, a quantidade de reagentes utilizados é mínima, não gerando resíduos ou apresentando riscos.
Gostou do experimento? Pretende usar nas suas aulas? Nós temos um kit pronto para emprestar para professores de Belo Horizonte e região, com os líquidos e o quadro mostrado aqui.
Comente abaixo se gostou do experimento.

