Neste artigo vamos falar sobre uma sequência de experimentos na qual os alunos investigam as evidências de reações químicas. Na sequência, usamos duas metodologias que podem facilitar muito a sua aplicação em sala de aula.
A primeira metodologia que vamos descrever é a “rotação de estações”. Nela, os alunos são divididos em grupos e cada grupo realiza ao mesmo tempo uma atividade diferente. Após um certo tempo pré-estabelecido, os grupos trocam de mesa, rodando pela sala e fazendo uma outra atividade. Isso continua até que todos os grupos tenham feito todas as atividades. Assim, levando em conta o tempo da aula e o número de alunos, o professor pode planejar atividades ao redor de um tema. O ideal é que cada atividade possa ser completada aproximadamente no mesmo tempo, de modo a não criar gargalos que impeçam a rotação dos grupos.
As atividades usadas na rotação podem incluir tanto a análise de textos, a realização de experimentos ou a manipulação de modelos, bem como atividades usando tecnologia, como simulações, a análise de vídeos ou animações. Uma grande vantagem desta metodologia é que como os alunos não estão todos realizando a mesma atividade ao mesmo tempo, você não precisa ter equipamentos e materiais em número suficiente para todos os grupos. Ou seja, caso você só tenha uma unidade de um equipamento mais caro ou mais difícil de achar, você ainda pode garantir que todos os alunos vão ter a oportunidade de utilizá-lo na aula no rodízio.
Com esta metodologia, vamos poder montar apenas um único kit para cada experimento (que nós chamaremos de uma “estação”. Os materiais ficam parados nas mesas e os alunos é que rodam pela sala.
Microescala - Química em gotas
Decidimos usar a microescala para os experimentos nessa rotação. Essa decisão levou em conta diversos fatores, como explicaremos adiante. Mas o que é a microescala? Basicamente, experimentos em microescala são experimentos feitos com quantidades reduzidas de reagentes. Graças ao trabalho de Bob Worley e outros pesquisadores (veja exemplos aqui e aqui), fazer experimentos usando a microescala não envolve mais a aquisição de equipamentos especializados.
Nós usamos frascos conta-gotas de 30 mL adquiridos em uma loja de embalagens plásticas. Criamos suportes para os frascos conta-gotas (opcionais) usando MDF de 3 mm e corte a laser. Fizemos pequenas espátulas e bastões para misturar as soluções (também opcionais) usando a impressora 3D. As reações são conduzidas diretamente sobre pastas plásticas em “L”, adquiridas em uma papelaria.
Dentre as vantagens de se realizar estes experimentos usando a microescala, podemos destacar:
- o gasto muito reduzido de reagentes;
- a facilidade de limpeza;
- a maior segurança nos procedimentos.
Ao se fazer essas reações em tubos de ensaio podemos gastar mililitros das soluções cada vez que um grupo de alunos faz cada experimento. Usando a microescala, gastamos apenas algumas gotas das soluções. Com isso, um frasco conta-gotas de 30 mL irá permitir centenas de repetições do experimento.
A limpeza utilizando apenas papel toalha também facilita enormemente os procedimentos, especialmente para o rodízio. Se a cada troca de estação os alunos tivessem que ir para uma pia lavar os tubos de ensaio, o avanço do rodízio seria mais lento. O foco dos experimentos deve ser a observação do que acontece e não a limpeza.
As estações
Vamos descrever as 6 estações que usamos para apresentar as evidências de reações químicas para os alunos. Em cada mesa, os alunos encontram uma folha impressa com instruções gerais, uma folha inserida em uma pasta plástica em L (sobre a qual serão feitas as reações) e uma folha contendo questões sobre os experimentos para conduzir a investigação e a discussão entre os alunos.
Estação 1 - Mudança de Cor
Nesta estação os alunos investigam as mudanças de cor de indicadores ácido-base ao se adicionar soluções ácidas e básicas. Em cada linha da folha colocamos um indicador diferente: azul de bromotimol, fenolftaleína, alaranjado de metila e indicador universal. Você pode usar qualquer outra combinação de indicadores sintéticos ou naturais. Após colocar uma gota de indicador em cada círculo, os alunos adicionam as soluções marcadas nas colunas: vinagre, água destilada, bicarbonato de sódio e hidróxido de sódio. A água serve como um controle, mostrando a cor do indicador em uma solução neutra. A solução de fenolftaleína é feita em álcool etílico e deve ser bem diluída. Como a fenolftaleína não é solúvel em água, ela pode precipitar se a solução for muito concentrada, ao ser colocada em água.
Os indicadores usados podem ser substituídos por extratos de vegetais contendo antocianinas, como o repolho roxo ou outras folhas, flores ou frutos coloridos.
Você pode ver e baixar o PDF das folhas usadas para o experimento e com as questões colocadas para os alunos.
PDF Estação 1: http://www.xciencia.org/wp-content/uploads/2022/08/evidencias-de-RQ-estacao-1-mudanca-de-cor.pdf
Estação 2 - Formação de Precipitado
A segunda estação traz a formação de compostos pouco solúveis em água – os precipitados. Na folha onde faremos as reações usamos círculos com o interior branco para precipitados coloridos e círculos pretos para precipitados brancos, de modo a aumentar o contraste e facilitar a visualização.
Novamente, você pode selecionar outras combinações de reagentes dependendo do material disponível. Nossa seleção inclui alguns materiais que são fáceis de encontrar, como os sais de cobre, ferro e cálcio.
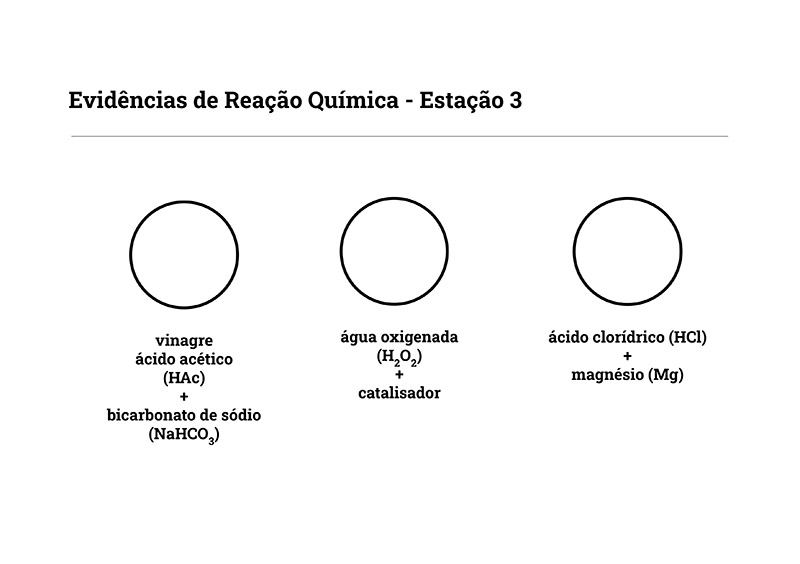
Estação 3 - Liberação de Gás
Os alunos investigam reações químicas em que acontece uma liberação de gás na terceira estação. Selecionamos 3 reações: a liberação de dióxido de carbono (CO2) na reação entre bicarbonato de sódio e vinagre; a decomposição da água oxigenada (H2O2) acelerada por um catalisador (usamos iodeto de potássio sólido); e finalmente, a liberação de hidrogênio na reação entre magnésio metálico e ácido clorídrico. É possível substituir o catalisador usado por outros compostos, como o dióxido de manganês retirado de uma pilha seca usada. O magnésio pode ser substituído por zinco em pó.
Estação 4 - Liberação de Calor
Uma evidência de reação química que não é tão “evidente”, pelo menos visualmente, é a liberação de energia na forma de calor. É claro que em alguns casos, como nas reações de combustão a liberação de calor fica bem visível, pois também ocorre a liberação de luz na chama. Mas em uma reação como a neutralização de um ácido com uma base, não existem evidências visíveis da liberação de energia. Para tornar essa liberação de calor visível, usamos uma folha de papel termocrômico, que muda de cor com a temperatura. Nós imprimimos um círculo na folha de papel termocrômico e inserimos a folha na pasta plástica. Ao misturar uma solução de ácido clorídrico 5 mol/L com uma solução de hidróxido de sódio 5 mol/L, vemos que o papel muda de cor. O papel termocrômico contém um corante que muda de cor com a temperatura.
Uma opção para substituir o papel termocrômico, que também não é muito fácil de ser encontrada é usar uma placa plástica contendo um cristal líquido que muda de cor com a temperatura. Outra possibilidade é utilizar um termômetro digital usado em culinária para acompanhar a temperatura da reação.
Estação 5 - Liberação de Luz
Para visualizar a liberação de energia na forma de luz, optamos por usar a reação quimioluminescente obtida nas pulseiras “neon”, vendidas em lojas de festas. As pulseiras consistem em um tubo de plástico que contém em seu interior um fino tubo de vidro. Parte dos reagentes é colocada no tubo de plástico e a outra parte está contida no tubo de vidro. Quando quebramos o tubo de vidro, os reagentes se misturam e podemos ver a emissão de luz.
Na nossa versão em microescala, resolvemos abrir os tubos de plástico usando um alicate de corte, anteriormente à aula. Separamos o tubo de vidro e o conteúdo do tubo de plástico em dois recipientes diferentes. Os alunos são orientados a colocarem duas gotas de cada solução sobre o círculo preto da folha inserida na pasta plástica.
Estação 6 - A Beleza da Química (vídeos)
Para a sexta estação, nós optamos por selecionar vídeos do site beatifulchemistry.net e do canal Beauty of Science. Os vídeos mostram reações químicas capturadas bem de perto, dando ênfase ao lado estético e com uma música ao fundo. Os vídeos também incluem equações químicas de cada reação apresentada. Os vídeos apresentam uma visão diferente das reações e permitem aos alunos começarem a relacionar aspectos da representação das reações com oque ocorre no nível macroscópico.
Nessa estação disponibilizamos uma folha com os links para os vídeos por extenso e na forma de QR Codes (para facilitar a visualização em smartphones.
Finalmentes
Nós utilizamos esta atividade, exatamente como descrita aqui nas nossas aulas no Colégio Técnico da UFMG e tudo correu como previsto. Nos 100 minutos de aula os estudantes conseguiram realizar todos os experimentos e responder às perguntas colocadas. Comparando esta atividade com a que era realizada anteriormente, usando tubos de ensaio, posso dizer que fizemos muito mais com muito menos: nenhuma vidraria quebrada, geração de resíduos muito menor e uma variedade maior de reações observadas.
Gostou da atividade? Compartilhe com seus colegas e deixe um comentário abaixo.







8 comentários
No experimento: Investigando as Reações Químicas: Microescala e Rotação de Estações, tinha escrito: “Você pode ver e baixar o PDF das folhas usadas para o experimento e com as questões colocadas para os alunos.” Vi esse comentário abaixo do link mas não encontrei onde está o PDF.
Kelly, obrigado pelo seu comentário, o plugin que publica os PDFs estava com um problema mas agora voltou a funcionar.
Olá Professor Alfredo. Muito obrigado pelas propostas, indicações e atividades! É tudo muito útil e importante! Não conhecia esse campo dos experimentos em micro escala. Bacana demais!
*Acho que os arquivos para download estão com algum problema pois não estão aparecendo.
Marcelo, tente recarregar a página, às vezes o servidor fica um pouco lento e pode dar algum problema. Esse plugin que mostra os PDFs já deu alguns problemas, mas agora está aparecendo normalmente pra mim aqui.
[…] Evidências de Reações e Rotação de Estações […]
Boa noite! Adorei os experimentos! Gostaria muito de aplicar com os meus alunos. Porém também não encontro onde baixar os PDFs…
Karen, realmente o plugin dos pdfs deu problema novamente. Resolvi isso tirando o plugin e colocando um link direto para os PDFs. Espero que dê tudo certo nos seus experimentos!
Consegui, Alfredo! Muito obrigada!
Estou amando o site!