Este é um experimento muito simples de se montar e que usa materiais fáceis de se encontrar. Vamos criar um belíssimo jardim de pedras, com “flores” brancas ou coloridas. De quebra, seus alunos vão investigar uma reação química, capilaridade, cristalização, solubilidade…
Assista o vídeo abaixo para conhecer melhor este experimento.
Montando o experimento
Para este experimento, você vai precisar localizar algumas pedras de brita, usadas em construção para se fazer concreto. A pedra deve ser feita de dolomita e para saber se você está com o tipo de pedra certa, basta você colocar algumas gotas de vinagre e ver se ocorre um desprendimento de pequenas bolhas de gás. Se borbulhar, você está com o material certo.
Nós usamos o fundo de garrafas de PET para fazer a reação, mas você pode utilizar outro recipiente se quiser. Coloque a pedra no fundo do recipiente e coloque vinagre até cobrir cerca de metade da altura da pedra.
Se você quiser flores coloridas, pinte a parte superior das pedras com uma caneta de ponta porosa (ou coloque uma gota de um corante alimentício).
Agora é só esperar. Deixe o recipiente em um lugar onde ele não vá atrapalhar e observe o acontece nos próximos dias. Se você estiver fazendo este experimento com diversos grupos de alunos, pode ser uma boa ideia colocar uma etiqueta ou usar uma caneta permanente para identificar os recipientes.
Depois dos alunos observarem os cristais formados, não descarte as pedras! Basta lavar e os cristais formados, solúveis em água, serão removidos e você pode usar as mesmas pedras por vários anos, basta adicionar mais vinagre.

O que acontece
A dolomita é um mineral composto de carbonato de magnésio e carbonato de cálcio. Tanto o carbonato de magnésio como o de cálcio são insolúveis em água. Mas, quando colocamos o vinagre em contato com a dolomita, uma reação química acontece. Uma evidência desta reação química é a formação de bolhas de gás na superfície das pedras.
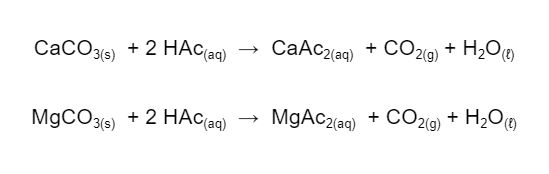
Como podemos ver nas equações químicas acima, os carbonatos de cálcio e magnésio reagem com o ácido acético do vinagre, formando os respectivos acetatos, bolhas de gás carbônico e água. Ao contrário dos carbonatos, os acetatos de cálcio e magnésio são solúveis em água. Assim, estamos dissolvendo um pouco das pedras ao colocá-las em vinagre, liberando íons de cálcio e magnésio.
Como as pedras são porosas, podemos logo perceber que a solução em que as pedras estão mergulhadas começa a subir por suas paredes. Isso ocorre por capilaridade, o mesmo fenômeno responsável pelo fato da água subir quando você coloca um pedaço de papel de filtro num copo com água. Como a água interage bem com o material que forma as paredes dos poros, a água vai molhando a superfície e subindo. Ao subir pela pedra, a água carrega junto com ela os íons vindos da reação do vinagre, ou seja, os acetatos de cálcio e magnésio. Como o passar do tempo, a água vai evaporando e com isso os sais dissolvidos vão cristalizando e formando belas estruturas. A água também carrega os corantes usados, que ficam presos nos cristais e colorem as “flores de pedra”.


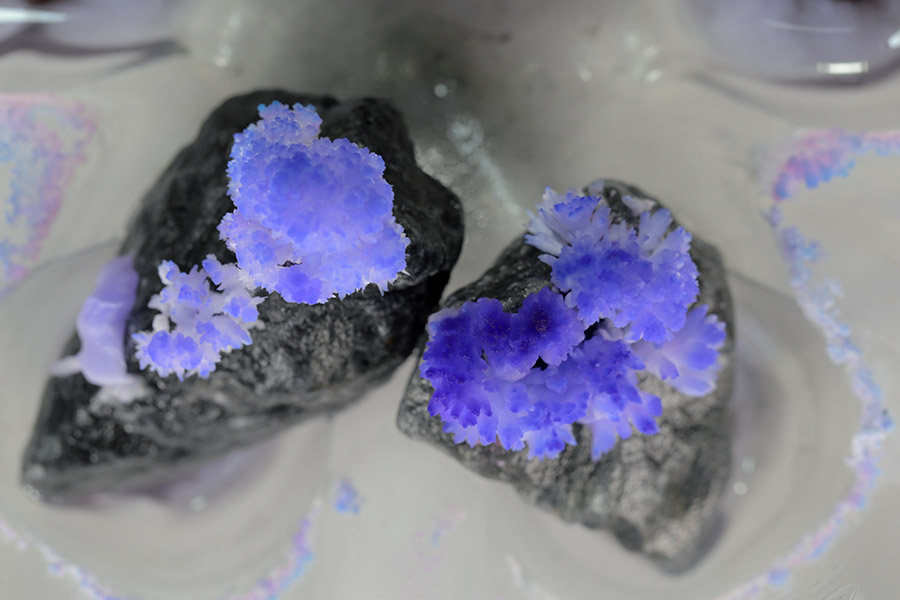

Uma variante interessante é usar uma caneta marca-texto fluorescente para colorir o topo da pedra. Após os cristais crescerem, você pode iluminá-los com uma lâmpada ultravioleta (luz negra) e observar a emissão de luz.


Finalmentes
Gostou do experimento? Deixe seu comentário abaixo e compartilhe com seus colegas. O que será que acontece se você usar outro ácido no lugar do vinagre? E se você usar outro material poroso no lugar das pedras? Coloque seus estudantes para investigar as possibilidades!


1 comentário
Passando para agradecer pelos materiais e conteúdos de qualidade. Estou aproveitando o máximo em minhas aulas de práticas experimentais e o meu trabalho está sendo muito bem reconhecido. Quando temos uma boa referência o resultado não poderia ser outro né. Hehehehe Gratidão!